SARS-CoV-2の起源:後編
なぜこのウイルスは私たちの間で効率良く感染し、拡散することができるのか?
症例提供:Dr Fabio Macori, Radiopaedia.org. 症例より rID: 74867
このミニシリーズの第1部では、SARS-CoV-2の起源に焦点を当てました。第2部では何が違うのか、そしてなぜ人に感染させることに長けているのかに焦点を当てました。この知識で武装した我々は「このウイルスは研究室で作られたものか?」という疑いにも対処することができるでしょう。
パート1のおさらい
まだ読んでいない方は、パート1をチェックすることをお勧めします。我々は科学者がどのようにして ウイルスの起源を調査するかについて紹介しました。そこから、SARS-CoV-2の起源に関する私たちの主要な仮説について議論しました。この仮説には2つの部分があります。
ウイルスゲノムのほとんどは、Bat CoV RaTG13と呼ばれるキクガシラコウモリのコロナウイルスと類似していると言われています。
スパイクタンパク質のすべての重要な受容体結合ドメイン(RBD)は、マレーセンザンコウで見つかった全く異なるコロナウイルスに非常に類似しています。
遺伝子組み換えと推定されるイベントによりどのような結末がもたらされたかは以前お話ししましたが、SARS-CoVよりも10倍優れた新しいRBDを獲得することとなりました。RBDはACE2と呼ばれる細胞表面のヒトタンパク質と結合し、SARS-CoV-2がどれだけ細胞内に侵入できるかに関わっています。SARS-CoV-2の新しいRBDは、ACE2との結合親和性が10倍に向上しています。
この第2部の記事を読む前に、我々は既にSARS-CoV-2がヒトへの感染に効果的な理由を説明するためのパズルのピースの一つを手に入れていることになります。
SARS-CoV-2が細胞に侵入する仕組み:スパイクタンパク質の活性化
上のYouTubeの動画では、SARS-CoV-2のスパイクタンパクを見ることができます。これは、タンパク質を上から下に見たところから始まり、横に回転して、上に戻ってきています。このタンパク質について重要なことは、このタンパク質が三量体で機能していることです。これは、このタンパク質の3つの同一のコピー(上の動画ではライトグレー、ダークグレー、ブルー)が一緒になってタンパク質の機能を果たすことを意味します。それが回転しているのを見ていると、何かが青色の単量体に何かが捲れたような感じでくっついて見えることに気づくかもしれません。これは、RBDがヒトACE2と結合しようとしているところです。
その前に、生化学的な背景を説明します。タンパク質は静的なものではありません。様々なことが原因で構造が変化することがあります。SARS-CoV-2のスパイクの場合、活性化するためにはタンパク質の一部を切断する必要があります。傘のボタンを押すようなものだと考えてください。ボタンを押すことで 傘は開き完全に「活性化された」状態になります。スパイクタンパク質を切断することで、感染性のある形になることができます。この活性化はタンパク質開裂(文字通り「タンパク質を切断するという意味」)と呼ばれ、SARS-CoV-2がACE2と結合して侵入する前に必要です。HIV、インフルエンザ、デングウイルスのような他の多くのウイルスもまた、エンベロープ/スパイクタンパク質を開裂し活性化させなければ、細胞に侵入することはできません。
他のタンパク質を開裂(切断)するタンパク質はプロテアーゼ(タンパク分解酵素)と呼ばれています。プロテアーゼがやみくもに切断を開始しないようにするために、プロテアーゼは標的タンパク質の配列の中にある特定の切断部位のみを認識します。切断部位の配列が分かれば、これが何によって開裂され、どこが開裂されるのか、時にはいつ開裂されるのかを知ることができます。しかし、なぜこれは重要なのでしょうか?
スパイクプロテインの秘密兵器:多塩基切断部位
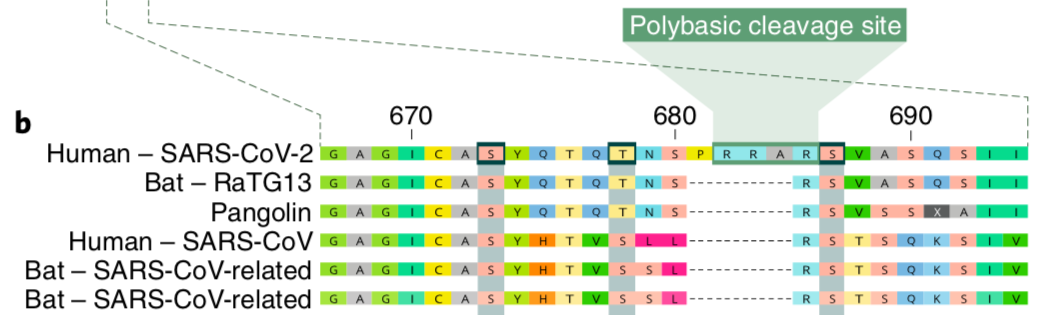
SARS-CoV-2に最も近いウイルスの切断部位のアミノ酸配列。Andersen氏らの報告 2020年より編集。
上の写真では、6種類のコロナウイルスのスパイクタンパク質の一部分のアミノ酸(タンパク質)配列が表示されています。SARS-CoV-2の最も近い親戚であるBat CoV RaTG13や、センザンコウコロナウイルスの配列も含まれます。この画像には、オリジナルのSARS-CoVと2つの追加のコウモリコロナウイルスも含まれています。この配列比較はある一つの事象を簡潔に説明するためです。すなわち、SARS-CoV-2は多塩基切断部位を持つ唯一の配列だということです。多塩基切断部位が何であるかを知らなくても、SARS-CoV-2が特異的であることがわかります。他のすべてのウイルスがギャップ(破線)を持っているのに対し、SARS-CoV-2のスパイクは余分なアミノ酸の塊を持っています(PRRAAと表示されています)。この4つの余分なアミノ酸は、SARS-CoV-2の効率的な増殖に非常に重要であることが判明しました。
多塩基開裂部位
多塩基開裂部位は発音しにくい単語(英語で)です。開裂部位配列がプロテアーゼにタンパク質をどこで切断するかを教えてくれることはすでに説明しました(スパイクの場合、これは活性化されていることを意味します)。オリジナルの SARS-CoV や他のコロナウイルスは、PRRA の余分な「R(アルギニン)」を欠いた一塩基開裂部位を持っています。多塩基切断部位を持つタンパク質は、多くの組織型に見られるプロテアーゼのフリンによって切断されるようになります。その逆は一塩基性開裂部位と呼ばれます。この部位を標的とするプロテアーゼは、体内の組織や場所のごく一部分に限定されている可能性があります。以上のことから言えるのは:
スパイクタンパク質に多塩基性の切断部位が含まれている場合、ウイルスはより多くの組織タイプで増殖し、大惨事を引き起こす可能性があります。
例えば、鳥インフルエンザ(他の多くのウイルスの中でも)では、高病原性株が多塩基切断部位を持つ場合、ウイルスは鳥の肺や腸以外の多くの組織で増殖し、病気の重症度(悪性度)が高くなります。
ここでは一塩基性開裂部位を示す「R」と多塩基性開裂部位を示す「R×R/K R」が表示されています。青色の星マーク(鶏の図の中の)は、どのような組織に感染し得るかを示します(Han et al. 2020より改変)。
覚えておいてほしい点は?スパイクタンパク質の多塩基切断(すなわちフリンの活性化)部位は、SARS-CoV-2の感染性および/または疾患の重症度を高める可能性があります。
SARS-CoV-2は隠れることができるのか?
ヒトの免疫系がSARS-CoV-2の感染をどのように処理するかについては、現在も研究が進んでいます。可能性の一つとしては、人間の免疫システムがSARS-CoV-2の標的を見つけ、抗体を産生することです。しかし、ウイルスが検出されないようにする方法を見つけたとしたらどうでしょうか?現在、感染したヒトがウイルスを中和する抗体を作ることができるという証拠がいくつかあり、そのような抗体反応が再感染を防ぐ可能性が示唆されている(少なくともマカク猿では)。しかし、これらの抗体反応が全体的にどの程度優れているのかはわかりません。 抗体がどのようにして感染を抑制するのか、少し時間をかけて考えてみましょう。
スパイクとACE2の結合をブロックする抗体で、細胞への侵入を防ぐ。Christian Stevens氏がBiorenderを使用し作成。
抗体がタンパク質の標的に結合すると、その標的をブロックするのに非常に効果的です。しかし、抗体は結合できないものとは戦えません。ヒトとの戦いに成功しているウイルスは、抗体から標的タンパク質を「隠す」(HIV)、あるいは時間の経過とともに標的の姿を変化させる(インフルエンザ)など、これに対処するためのさまざまな戦略を持っています。SARS-CoV-2はあまり速く変化していないように見えますが、何が抗体から「隠れる」ことに貢献しているでしょうか?
O結合糖鎖
O-linked glycan(O結合糖鎖)とは、タンパク質の表面に付着している糖分子のことです。私たちの体の中では、血液型などを示すためにタンパク質の旗のように使用されることがあります。また、抗体のようにタンパク質の構造を維持するのに役立っていることもあります。 不思議なことに、SARS-CoV-2スパイクの多塩基切断部位のすぐ隣に新たにO結合糖鎖を獲得しています。
一つの仮説としては、この糖鎖が一種の盾となって、スパイクタンパク質が抗体に認識されないように「隠蔽」しているというものです。私たちの免疫システムが抗体が標的とする重要な部位を探すとき、それらの抗体を避けるウイルスは選択的に優位に立ちます。 ウイルスは意識的にこれを行うことはありません(第1部の自然淘汰の説明を覚えていますか?)抗体が標的が見えるところにあるすべてのウイルスをブロックし始めると、標的領域の近くにO結合糖鎖をもたらす突然変異を起こしたウイルスは、私たちの免疫系による検出から標的を遮蔽します。これはglycan shieldとして知られています。
Karsten、Alter 2017らの報告から改変。 黄色のクラスターは、抗体から緑色のタンパク質を隠す糖鎖を示しています。
では、SARS-CoV-2は何故人間に感染し、拡散するのが得意なのでしょうか?
スパイクタンパク質は、ヒトACE2を結合させて細胞内に侵入するのに非常に優れています(第1部を参照)
スパイクタンパク質は、幅広い細胞や組織で活性化することができます(多塩基切断部位)
スパイクタンパク質は抗体から隠れることができるかもしれません(glycan shield)
SARS-CoV-2はいつどのようにしてこれらの道具を開発したのか?
SARS-CoV-2のゲノムの大部分は、コウモリやセンザンコウに生息する他の近縁のウイルスと類似しているため、スパイクがACE2をどのようにして結合するのか、その起源はよくわかっています。しかし、多塩基切断部位とO結合糖鎖付加部位はSARS-CoV-2だけが持っている装備です。これらの特徴はどの段階で獲得できたのでしょうか?
仮説1:ヒトへの波及前
仮説2:ヒトで増幅している間(つまり複製している)間
率直にネタばらしすれば、この質問に答えるための決定的な証拠はまだ見つかっていません。
仮説1が正しければ、野生のどこかに、SARS-CoV-2と非常によく似たウイルスの貯蔵庫があるということになります。それがセンザンコウであろうと、コウモリであろうと、あるいは他の中間的な動物であろうと、すでに他のSARSに似たウイルスが存在していて、それが再び人間に波及する手段を持っている可能性があります。これが本当だと分かれば、そのような事態に備えて、監視プログラムを開発したり、潜在的な薬剤やワクチンを作成したりするために、今すぐに行動を起こすことができるでしょう。
仮説2が正しければ、SARS-CoV-2が最初にヒトと相互作用したとき、おそらくMERSのようにあまりうまく複製して広がらなかったのではないでしょうか。しかし、ウイルスが複製サイクルの間に変異し、いくつかの変異体は多塩基切断部位とグリカン遮蔽を獲得した。そうすることで、彼らは自然淘汰のゲームで優位に立ち、人間の間に広まるために飛び立ったのです。もしそうだとすれば、新たな感染症が発生していないかどうかを監視し、そのような波及ウイルスが人間の間で拡散する前に捕まえるための対策を講じることができるでしょう。
SARS-CoV-2の基礎科学研究はまだ始まったばかりであり、これらの特定の突然変異の正確な起源が明らかになるまでには、野生の他のコロナウイルスの配列決定が必要になるでしょう。しかし、この質問に対する答えを発見することは、次のコロナウイルスの大発生が今日のSARS-CoV-2のような深刻さに達する前に、その予防や管理の計画を立てるのに役立つでしょう。
多くの科学者にとっては もっと研究をしないと話が進まない状態です。動物の貯蔵庫の情報が得られ、感染経路や病原体の情報が得られました。次の科学的な疑問に どう答えるかのアイデアが出てきました。ほとんどの科学者はこれまでの成果を見て、正しい道を歩んでいると言うでしょう。というのも、
これまでに収集したすべてのデータが、我々の仮説に合致しているからです。
我々の仮説は、最も分かりやすく、『オッカムの剃刀』(ある事柄を説明するために必要以上に多くの仮定を用いるべきではないという指針)に合致するものです。
私たちの仮説は検証可能です。
このことは、ウイルスが研究室で設計されたものではなく、改変されたものでもないことを強く示唆しています。
しかし、インターネット上には科学者ではない人たちがたくさんいて、その人たちの質問は科学的な型には全く合わないのです。そして、代替理論を検討することが重要です。パート3では、この新しいコロナウイルスの起源を取り巻く他の説や恐れを直接検証していきます。
それまでには、第1部と第2部で科学的に厳密な答えが得られたことを願っています!第3部では、陰謀論に立ち向かうためのツールを手に入れた今、陰謀論者に直接呼びかけることにします。
執筆: Christian Stevens
現在、Mount Sinai School of MedicineでMD/PhDコースの大学院生として研究に従事。Harvey Mudd College卒業。
2018年にBenhur Lee Labで研究活動を開始。現在、2つのプロジェクトに取り組んでいます。
一つはSendaiウイルスをVectorとして用いて遺伝子改変するというもの、もう一つはnext-generation sequence (Illumina, Oxford Nanopore等)の解析パイプライン構築。
また世界規模の臨床研究の成果(特に感染、ウイルス領域の)を幅広くすべての患者に提供することにも興味を持ってます。
christian.stevens@icahn.mssm.edu
Twitter: @csstevens91